ဆာလဖျူရစ်အက်ဆစ်
ဆာလဖျူရစ်အက်ဆစ် (အင်္ဂလိပ်: Sulfuric acid) သည် ရှိသမျှ အက်ဆစ် အပေါင်းတို့တွင် အရေးပါအရာရောက်ဆုံး အက်ဆစ်ဖြစ်သောကြောင့် ကမ္ဘာပေါ်ရှိမည်သည့်လုပ်ငန်းများ၌မဆို ထိုအက်ဆစ်မပါလျှင် မပြီးနိုင်သလောက် ဖြစ်လေသည်။ ဆာလဖျူရစ်အက်ဆစ်သည် ဆီကဲ့သို့သော အရည်ဖြစ်၍ အရောင်အဆင်းလည်းမရှိ၊ အနံလည်းမရှိချေ။[6] ရေထက်နှစ်ဆ နီးပါးမျှပို၍လေးပြီး အက်ဆစ်အပြင်းရည်သည် အောက်ဆီဂျင်ဓာတ် ပေးစွမ်းနိုင်သော ဓာတ်ပစ္စည်းဖြစ်သည့်ပြင်၊ ရေနှင့် အလွန်ပေါင်းစပ်လွယ်၏။ စိုစွတ်ထိုင်းမှိုင်းသော ဓာတ်ငွေ့ပုလင်းထဲသို့ ထိုဆာလဖျူရစ် အက်ဆစ်ရည်ထည့်လိုက်သောအခါ ဓာတ်ငွေ့တွင် ရှိနေသော ရေငွေ့ကို ဆာလဖျူရစ် အက်ဆစ်က စုပ်ယူလိုက်သဖြင့် ခြောက်သွား၏။ ထို့ကြောင့် ဤအက်ဆစ် သည် စိုစွတ်ထိုင်းမှိုင်းနေသော ပစ္စည်းများကို ခြောက်အောင် လုပ်ပေးနိုင်သော ဓာတ်ပစ္စည်းတစ်ခု အဖြစ်ဖြင့်လည်း အသုံးဝင်၏။ မည်မျှ လောက် ရေနှင့်ပေါင်းစပ်လွယ်သနည်းဟူမူ သကြား၊ ကော်မှုန့်၊ စက္ကူ၊ သစ်သားစ၊ ဝါဂွမ်းစသောပစ္စည်းများပေါ်သို့ ဆာလဖျူရစ်အက်ဆစ်ရည်ကို အစက်ချပေးလိုက်လျှင်ပင် ထိုပစ္စည်းများတွင်ရှိသော ရေကို အက်ဆစ်က ထုတ်ယူလိုက်သောကြောင့် ကာဗွန်အမည်းသာလျှင် ကျန်ရစ်သည်ကို တွေ့ရသည်။ ထိုအက်ဆစ်ကို ရေနှင့်ရောစပ်သောအခါ အပူဓာတ် ပေါ်လာ၏။ အပူဓာတ် ပေါ်လာကြောင်းကို ဤသို့သိအပ်၏။ ရေရှိသော ခွက်တစ်ခွက်ထဲသို့ ဆာလဖျူရစ်အက်ဆစ်အပြင်း ရည်ကို တဖြည်းဖြည်း လောင်းထည့်၍ မွှေပေးလိုက်သောအခါ ရေပူလာသည်ကိုတွေ့ရ၏။ အက်ဆစ်အပြင်းရည်ထဲသို့ ရေအစက်အနည်းငယ် ချပေးလိုက်လျှင်လည်း ရေသည်တမုဟုတ်ခြင်း အလွန်ပူလာသဖြင့် တခါတရံ အက်ဆစ်ရည်သည်ပင်လျှင် စင်၍ထွက်လာတတ်၏။ ထို့ကြောင့် အက်ဆစ်အပြင်းရည်ကို အပျော့ရည်ပြုလုပ်လိုသောအခါ အက်ဆစ်ထဲသို့ ရေကိုမလောင်း ထည့်ဘဲ၊ ရေထဲသို့သာ အက်ဆစ်ရေကို တဖြည်းဖြည်းလောင်း ထည့်၍ မွှေပေးရလေသည်။ အသားပေါ်သို့ အက်ဆစ်ကျရောက် လျှင် အသားကိုလောင်တတ်သည်။
| |||
 | |||
 | |||
| အမည် | |||
|---|---|---|---|
| IUPAC name
Sulfuric acid | |||
| အခြားအမည်များ
Oil of vitriol, hydrogen sulfate | |||
| အမှတ်အသားများ | |||
CAS Number |
7664-93-9 | ||
| ChEBI | CHEBI:26836 | ||
| ChEMBL | ChEMBL572964 | ||
| ChemSpider | 1086 | ||
| EC Number | 231-639-5 | ||
Gmelin Reference |
2122 | ||
| Jmol 3D model | Interactive image | ||
| KEGG | D05963 | ||
| PubChem | 1118 | ||
| RTECS number | WS5600000 | ||
| UNII | O40UQP6WCF | ||
| UN number | 1830 | ||
InChI
| |||
SMILES
| |||
| ဂုဏ်သတ္တိများ | |||
ဓာတုဗေဒ ဖော်မျူလာ |
H 2SO 4 | ||
| Molar mass | 98.079 g/mol | ||
| ရုပ်အဆင်း | Clear, colorless liquid | ||
| အနံ့ | odorless | ||
| သိပ်သည်းမှု | 1.84 g/cm3, liquid | ||
| အရည်ပျော်မှတ် | ၁၀ ဒီဂရီ စင်တီဂရိတ် (၅၀ ဒီဂရီ ဖာရင်ဟိုက်; ၂၈၃ ကယ်လ်ဗင်) | ||
| ရေဆူမှတ် | ၃၃၇ ဒီဂရီ စင်တီဂရိတ် (၆၃၉ ဒီဂရီ ဖာရင်ဟိုက်; ၆၁၀ ကယ်လ်ဗင်) When sulfuric acid is above ၃၀၀ ဒီဂရီ စင်တီဂရိတ် (၅၇၂ ဒီဂရီ ဖာရင်ဟိုက်), it will decompose slowly | ||
ရေထဲပျော်ဝင်မှု |
miscible | ||
| ရေငွေ့ ဖိအား | 0.001 mmHg (20 °C)[1] | ||
| အက်စစ် ပါဝင်မှု (pKa) | −3, 1.99 | ||
| ပျစ်စေးမှု | 26.7 cP (20 °C) | ||
| သာမိုဓာတုဗေဒ | |||
Std molar အင်ထရိုပီ (S |
157 J·mol−1·K−1[2] | ||
Std enthalpy of formation (ΔfH |
−814 kJ·mol−1[2] | ||
| အန္တရာယ် | |||
| Safety data sheet | External MSDS | ||
| GHS pictograms |  | ||
| GHS signal word | Danger | ||
GHS hazard statements |
H314 | ||
GHS precautionary statements |
P260, P264, P280, P301+330+331, P303+361+353, P363, P304+340, P305+351+338, P310, P321, P310, P405, P501 | ||
EU classification (DSD) |
|||
| R-phrases | R35 | ||
| S-phrases | တမ်းပလိတ်:S1/2 S26 S30 S45 | ||
| NFPA 704 |
0
0
0
| ||
| Flash point | Non-flammable | ||
Threshold limit value |
15 mg/m3 (IDLH), 1 mg/m3 (TWA), 2 mg/m3 (STEL) | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (median dose) |
2140 mg/kg (rat, oral)[5] | ||
LC50 (median concentration) |
50 mg/m3 (guinea pig, 8 hr) 510 mg/m3 (rat, 2 hr) 320 mg/m3 (mouse, 2 hr) 18 mg/m3 (guinea pig)[5] | ||
LCLo (lowest published) |
87 mg/m3 (guinea pig, 2.75 hr)[5] | ||
| US health exposure limits (NIOSH): | |||
PEL (Permissible) |
TWA 1 mg/m3[1] | ||
REL (Recommended) |
TWA 1 mg/m3[1] | ||
IDLH (Immediate danger) |
15 mg/m3[1] | ||
| ဆက်စပ် ဒြပ်ပေါင်းများ | |||
ဆက်စပ်သော strong acids |
Selenic acid Hydrochloric acid Nitric acid Chromic acid | ||
ဆက်စပ် ဒြပ်ပေါင်းများ |
Sulfurous acid Peroxymonosulfuric acid Sulfur trioxide Oleum | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
| Infobox references | |||
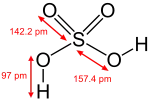
ဆာလဖျူရစ်အက်ဆစ် ချက်ယူကြရာ၌ အသုံးပြုသော နည်းနှစ်နည်းမှာ ခဲဖြင့်စီမံထားသော အခန်းတွင် ချက်သော နည်းဟောင်းနှင့် ဓာတ်ကူပစ္စည်းကိုသုံး၍ ချက်ယူသော နည်း သစ်ဖြစ်၏။ ဆာလဖျူရစ်အက်ဆစ် မော်လီကျူးတစ်ခုတွင် ဟိုက်ဒရိုဂျင်အက်တမ်နှစ်ခု၊ ဆာလဖာ (ကန့်) အက်တမ်တစ်ခု နှင့် အောက်ဆီဂျင် အက်တမ်လေးခုပါဝင်လျက်ရှိ၍၊ ထိုအက်ဆစ်၏ ဓာတုသင်္ကေတမှာ H2SO4 ဖြစ်၏။ ဆာလဖျူရစ်အက်ဆစ်ကို ချက်ယူသော ပထမနည်း ဟောင်းတွင် လိုအပ်သောပစ္စည်းများမှာ (၁) ဆာလဖာ ဒိုင်အောက်ဆိုက် SO2 (၂) နိုင်ထရစ် အောက်ဆိုက် NO (၃) လေ (၄) ရေနွေးငွေ့ သို့မဟုတ် ရေတို့ ဖြစ်ကြ၏။ ပထမ၌ လေထဲတွင်ပါသော အောက်ဆီဂျင်သည် နိုက်ထရစ်အောက် ဆိုက်နှင့် ပေါင်းလိုက်သောအခါ နိုင်ထရိုဂျင် ပါအောက်ဆိုက် ရ၏။ ဆာလဖာ ဒိုင်အောက်ဆိုက်နှင့် လေတို့ကို ထိုသို့ရခဲ့သော နိုက်ထရိုဂျင် ပါအောက်ဆိုက် NO2 နှင့် ရေနွေးငွေ့ တွင်ရော၍ ချက်လိုက်သောအခါ ဓာတ်ဖောက်ပြန်မှုများ ဖြစ်ပေါ်လာပြီးလျှင် နောက်ဆုံး၌ ဆာလဖျူရစ်အက်ဆစ် H2SO2 ရည်ကိုရရှိသည်။ နိုက်ထရိုဂျင် ပါအောက်ဆိုက် NO2 နှင့် ဆာလဖာ ဒိုင်အောက်ဆိုက် SO2 တို့ကိုရော၍ ချက်သော အခါ NO2 မှ အောက်ဆီဂျင်ဓာတ် ကွဲထွက်လာပြီးလျှင် SO2 နှင့်ပေါင်းစပ်သဖြင့် SO2 သည် ဆာလဖာထရိုင် အောက်ဆိုက် SO3 ဖြစ်လာ၍ NO2 သည် နိုက်ထရစ်အောက်ဆိုက် NO ဖြစ်လာလေသည်။
ဖြစ်လာပုံမှာ- SO2 + NO2 = SO3 + NO
- ဆာလဖာဒိုင်အောက်ဆိုက်+နိုက်ထရိုဂျင်ပါအောက်ဆိုက် = ဆာလဖာထရိုင်အောက်ဆိုက်+နိုက်ထရစ်အောက်ဆိုက်
- ဆာလဖာဒိုင်အောက်ဆိုက်+နိုက်ထရိုဂျင်ပါအောက်ဆိုက် = ဆာလဖာထရိုင်အောက်ဆိုက်+နိုက်ထရစ်အောက်ဆိုက်
တဖန် SO3 နှင့် ရေနွေးငွေ့တို့ရောစပ်ကြရာမှ H2SO2 ကို ရရှိပုံမှာSO3 + H2O = H2SO4
နိုက်ထရစ်အောက်ဆိုက် NO သည် လေထဲမှ အောက်ဆီ ဂျင်ဓာတ်ကို ရသောကြောင့် နိုက်ထရိုဂျင်ပါအောက်ဆိုက် NO2 အဖြစ်သို့ တဖန်ပြောင်းလဲသွားပြီးလျှင် SO2 နှင့်ပေါင်းစပ်ပြန် ၏။ ဤသို့လျှင် ဓာတ်ပေါင်းစပ်မှုတို့သည် အဆက်မပြတ် ဖြစ် နေလေသည်။
ဖြစ်နေပုံမှာ-
2NO + O2 = 2NO
SO2 + NO2 = SO3 + NO
SO3 + H2O = H2SO4
2NO + O2 = 2NO3
ဒုတိယနည်းဖြင့် ချက်ယူသော နည်းသစ်တွင် လိုအပ်သော
ပစ္စည်းများမှာ (၁) ဆာလဖာ ဒိုင်အောက်ဆိုက် SO2 (၂) လေ
(၃) ပလက်တီနမ်တို့ဖြစ်ကြ၏။ ခြောက်သွေ့၍ မည်သည့်
အညစ်အကြေးမှ ရောမနေသော ဆာလဖာ ဒိုင်အောက်ဆိုက်
SO2 သန့်သန့်ကို လေနှင့်ပေါင်းစပ်ပြီးနောက် အလွန်ပူအောင်
မီးပြင်းတိုက်ထားသော ပလက်တီနမ်အမှုန့်များရှိရာသို့ သွင်းလိုက်သောအခါ SO2 သည် လေထဲမှ အောက်ဆီဂျင်ဓာတ်ကို
ရရှိသဖြင့် SO3 ဖြစ်သွားသည်။ ဤနေရာ၌ ပလက်တီနမ်
အမှုန့်သည် မည်ကဲ့သို့မျှ ဓာတ်ဖောက်ပြန်ခြင်းမရှိဘဲ၊ ဓာတ်ကူ ပစ္စည်းအနေဖြင့်သာ ပါဝင်သည်။ ထိုရရှိသော SO3 ကိုရေနှင့်
ရောစပ်လိုက်သောအခါ H2SO4 ကိုရရှိ၏။
ရရှိပုံမှာ-
2SO2 + O2 + ပလက်တီနမ်မှုန့် = 2SO3 +ပလက်တီနမ်မှုန့် SO3 + H2O = H2SO4
တွင်းထွက်ရေနံစိမ်းသည် အညစ်အကြေးများနှင့် ရောနှော လျက်ရှိရာ ဆာလဖျူရစ်အက်ဆစ်ဖြင့် စင်ကြယ်အောင် ပြုလုပ် ပေးရ၏။ ဤအက်ဆစ်ကို ဓာတ်မြေဩဇာများ ပြုလုပ်ရာ၌ လည်းများစွာ အသုံးပြုရ၏။ ထိုဓာတ်မြေဩဇာကို ဟူပါဖော့ စဖိတ်ဟုခေါ်၏။ ထို့ပြင် ဓာတ်ပစ္စည်းများ ပြုလုပ်ရာ၌၎င်း၊ သံနှင့် သံမဏိလုပ်ငန်းများ၌လည်းကောင်း၊ ကျောက်မီးသွေးမှဓာတ်ပစ္စည်း များချက်လုပ်သော လုပ်ငန်းများ၌လည်းကောင်း၊ ပေါက်ကွဲစေတတ်သည့် ခဲယမ်းမီးကျောက်များ ပြုလုပ်ရာ၌လည်ကောင်း၊ ရက်ထည်များပြုပြင် လုပ်ကိုင်ရာ၌လည်ကောင်း၊ ပိုးတုအထည်များ စီမံပြုလုပ်ရာ၌လည်ကောင်း သံမပါ သည့်သတ္တုဗေဒလုပ်ငန်းများ၌လည်ကောင်း၊ အခြားအထွေအထွေလုပ်ငန်း များ၌လည်ကောင်း ဤအက်ဆစ်ကို အသုံးပြုကြရ၏။ ဤမျှမကသေး ဆာလဖျူရစ်အက်ဆစ်သည် ဟိုက်ဒရို ကလောရစ်အက်ဆစ် HCI နိုက်ထရစ် အက်ဆစ် HNO3 နှင့် အခြား အက်ဆစ်များခပ်ယူရာ၌လည်ကောင်း အဝတ်လျှော်ဆိုဒါနှင့် ဖော့စဖောရပ်များပြုလုပ်ရာ၌လည်ကောင်း၊ များစွာအသုံးဝင်သေး၏။ ဤမျှအသုံးဝင်သော်လည်း ဤအက်ဆစ်ကို တနေရာမှ တနေရာသို့ အမြောက်အများ သယ်ယူပို့ဆောင်ရန် အလွန် ခက်ခဲသည့်အတွက် အများအစားအသုံးပြုကြသော လုပ်ငန်းရှင် ကြီးများသည် များသောအားဖြင့် မိမိတို့ဖာသာ အက်ဆစ်ကို ချက်ယူကြလေသည်။[7]
ကိုးကား
- NIOSH Pocket Guide to Chemical Hazards #0577။ National Institute for Occupational Safety and Health (NIOSH)။
- Zumdahl, Steven S. (2009)။ Chemical Principles 6th Ed.။ Houghton Mifflin Company။ p. A23။ ISBN 0-618-94690-X။
- NuGenTec Material Safety Datasheet-Sulfuric acid။ 15 February 2013 တွင် မူရင်းအား မော်ကွန်းတင်ပြီး။ 28 January 2017 တွင် ပြန်စစ်ပြီး။
- Sulfuric acid IPCS။ “The substance is harmful to aquatic organisms.(ENVIRONMENTAL DATA)”
- Sulfuric acid။ Immediately Dangerous to Life and Health။ National Institute for Occupational Safety and Health (NIOSH)။
- Sulfuric acid safety data sheet။ arkema-inc.com။ 17 June 2012 တွင် မူရင်းအား မော်ကွန်းတင်ပြီး။ 8 March 2016 တွင် ပြန်စစ်ပြီး။ “Clear to turbid oily odorless liquid, colorless to slightly yellow.”
- မြန်မာ့စွယ်စုံကျမ်း၊ အတွဲ(၄)