ဖလိုရင်း
ဖလိုရင်း (Fluorine- ဓာတုသင်္ကေတ F) သည် ဒြပ်စင်အားလုံး၏ အီလက်ထရွန် အနုတ်လက္ခဏာနှင့် ဓာတုဓာတ်ပြုနိုင်မှု အကောင်းဆုံးဖြစ်ပြီး၊ စိမ်းဝါရောင် နှင့် Gaseous halogen ပေါင်းစည်းအား (၁) ရှိ သည်။ ဖလိုရင်းသည် Noble gases ဖြစ်သော Krypton, xenon ,radon နှင့် အခြားသော ဒြပ်စင်များနှင့် ဓာတ်ပေါင်းများ ဖြစ်ရန် လွယ်ကူပါသည်။ ထို့အပြင် ဖန်၊ သတ္တု၊ ရေ နှင့်အခြားသော အရာဝတ္ထုများနှင့်လည်း ဓာတ်ပြုနိုင်ပြီး ဖလိုရင်း ဓာတ်ငွေ့ဖြင့် မီးတောက်ကို ပိုမို တောက်စေနိုင်ပါသည်။ အပေါင်းလက္ခဏာ ရှိသော counterpart အချို့နှင့် ဖလိုရိုက် ပေါင်းစပ်၍ ဖလိုရင်း ဓာတ်ပေါင်းများ ဖြစ်စေနိုင်ပါသည်။
 Liquid fluorine at cryogenic temperatures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ယေဘုယျ ဂုဏ်သတ္တိများ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| အမည်၊ သင်္ကေတ | ဖလိုရင်း, F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အသံထွက် | /ˈflʊəriːn/, /ˈflʊərɪn/, /ˈflɔːriːn/ FLOOR-een, FLOOR-in, FLOHR-een | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အော်လိုထရိုဖီ | alpha, beta | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အဆင်း | gas: very pale yellow liquid: bright yellow solid: alpha is opaque, beta is transparent | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဒြပ်စင်အလှည့်ကျဇယားရှိ ဖလိုရင်း | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အက်တမ် အမှတ်စဉ် (Z) | 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အုပ်စု၊ ဘလော့ | group 17 (halogens), p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဒြပ်စင်အလှည့်ကျဇယား | period 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဒြပ်စင် ကဏ္ဍ | diatomic nonmetal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| စံ အက်တောမစ် အလေးချိန် (±) (Ar) | 18.998403163(6)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အီလက်ထရွန် ပြုပြင်မှု | [He] 2s2 2p5[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အခွံတစ်ခုလျင် အီလက်ထရွန်ပါဝင်မှု | 2, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ရုပ်ပိုင်းဆိုင်ရာ ဂုဏ်သတ္တိများ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဖေ့စ် | အငွေ့ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အရည်ပျော်မှတ် | 53.48 K (−219.67 °C, −363.41 °F)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အရည်ဆူမှတ် | 85.03 K (−188.11 °C, −306.60 °F)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| သိပ်သည်းမှု (သုည °C) | 1.696 g/L[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (အရည်ဆူမှတ်) | 1.505 g/cm3[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| သုံးပွင့်ဆိုင်မှတ် | 53.48 K, 90 kPa[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 144.41 K, 5.1724 MPa[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အငွေ့ပျံခြင်း အပူ | 6.51 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| မိုလာ အပူအင်အား | Cp: 31 J/(mol·K)[5] (at 21.1 °C) Cv: 23 J/(mol·K)[5] (at 21.1 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ငွေ့ရည်ဖိအား
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အက်တောမစ် ဂုဏ်အင်များ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အောက်ဆိုဒ်ဒေးရှင်း အခြေနေ | −1 (oxidizes oxygen) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အီလက်ထရွန် ဆန့်ကျင်ဘက်ဓာတ် | Pauling scale: 3.98[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အိုင်ယွန်းပြုခြင်းစွမ်းအင် | 1st: 1681 kJ/mol 2nd: 3374 kJ/mol 3rd: 6147 kJ/mol (more)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ကိုဗေးလန့်အချင်းဝက် | 64 pm[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဗန်ဒါဝေါ့စ် အချင်းဝက် | 135 pm[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ပုံဆောင်ခဲ ဖွဲ့စည်းပုံ | cubic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အပူစီးကူးမှု | 0.02591 W/(m·K)[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| သံလိုက်ဓာတ် | diamagnetic (−1.2×10−4)[10][11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7782-41-4[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| သမိုင်းကြောင်း | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အမည်တပ်ခြင်း | after the mineral fluorite, itself named after Latin fluo (to flow, in smelting) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ရှာဖွေတွေ့ရှိမှု | André-Marie Ampère (၁၈၁၀) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ပထမဆုံး ခွဲထုတ်မှု | Henri Moissan[2] (June 26, 1886) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အမည်တပ် ခဲ့ | Humphry Davy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Most stable isotopes of ဖလိုရင်း[12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
အသုံးပြုခြင်းများ
အက်တမ် အခြေအနေနှင့် မော်လီကျူး အခြေအနေတွင် ရှိကြသော ဖလိုရင်းများကို လျှပ်ကူးပစ္စည်းထုတ်လုပ်ရာ၌ ပလပ်စတစ် ပုံဖော်ရာတွင်လည်းကောင်း၊ Flat panel နှင့် MEMs ထုတ်လုပ် ပြသရာတွင်လည်း ကောင်း အသုံးပြုနိုင်ပါသည်။ ယူရေနီယမ် ထုတ်လုပ်ရာတွင် ဖလိုရင်းကို ဖယ်ယွန် (ferron) ကဲ့သို့ သော်လည်းကောင်း၊ ဟေလွန် (halon) အတွင်းရှိ တတ်ဖလွန် (teflon) ကဲ့သို့သော်လည်းကောင်း အရာဝတ္ထု ပွတ်တိုက်ခြင်းနိယာမ အရ တိုက်ရိုက်အသုံးမပြုနိုင်ပါ။
သဘာဝပတ်ဝန်းကျင်တွင် တွေ့ရှိရမှုအခြေအနေ
ကမ္ဘာပေါ်တွင် ဖလိုရင်းသတ္တုကို နှစ်အလိုက်ထုတ်လုပ်မှုမှာ ၄သန်း မတ်ထရစ် တန် နီးပါရှိပြီး၊ အရန်သတ္တု မှာသန်း ၁၂၀ မတ်ထရစ်တန် ခန့်ရှှိခဲ့ပါသည်။ အဓိကသတ္တုတွင်း နေရာများမှာ တရုတ်၊ မကဆီကို နှင့်အနောက်ဥရောပနိုင်ငံများဖြစ်ကြသည်။ ဖလိုရင်းကို သဘာဝ တွင် ရွှံစေး၊ ကျောက်မီးသွေး၊ ကျောက်တုံးတို့ တွင်တွေ့နိုင်ပါသည် ။ ဖလိုရင်းသည် လေထဲတွင်ပျံနှံနေပြီး အနည်ထိုင်လေ့ရှိသည်။ ဖလိုရင်းသည် မြေဆီလွှာတွင် ခန့်မှန်းခြေ ၃၃၀ ပီပီအမ် (ppm)ခန့်ပါဝင်ပြီး ၁၄၀ မှ ၄၀၀ ပီပီအမ်(ppm)ထိအစီအရီ ရှိနေတတ်သည်။ အချို့မြေဆီလွှာများတွင် ဖလိုရင်းကို ၁၀၀၀ ပီပီအမ် (ppm) ခန်တွေ့ရှိရပြီး မြေဆီလွှာညစ်ညမ်းမှုကို ၃၅၀၀ ပီပီအမ် (ppm) တွင်တွေ့ရှိရသည်။ စက်ရုံတွေတွင် ဟိုက်ထရိုဂျင်ဖလိုရိုက် ကိုလေထဲမှ ဖယ်ထုတ်ပြီး အပူနှင့်အလင်းကိုထုတ်လုတ်နိုင်ပါသည်။
ကျန်းမာရေးဆိုင်ရာသက်ရောက်မှုများ
သဘာဝတွင်ရှိသော ဖလိုရင်း ပမာဏအနည်းငယ်သည် ရေ၊ လေ၊ အပင် နှင့် တိရစ္ဆာန်များတွင် တွေ့ရပါသည်။ လူသားများအတွက် zysteကျိုးရလဒ်များမှာ အစားအစာ၊ သောက်သုံးရေ နှင့် အသက်ရှူသည့် လေများကို ဖလိုရင်း ဖြတ်၍ export ဖြစ်စေပါသည်။ ဖလိုရင်းကို အရေအတွက် အနည်းငယ်ရှိသော အစားအစာများ ထဲများတွင် တွေ့နိုင်ပြီး၊ အရေအတွက်များပြားသော အခွံမာရှိသည့် စားကောင်းသည့် ရေသတ္တဝါ နှင့် လက်ဖက်ရည်များတွင် ဖလိုရင်းကိုတွေ့နိုင်ပါသည်။ ဖလိုရင်းသည် ရိုးတွင်းချဉ်ဆီများ ထိန်းသိမ်းရာတွင် အဓိကလိုအပ်ပါသည်။ အကယ်၍ဖလိုရင်းကို တစ်နေ့လျှင်နှစ်ကြိမ် သွားတိုက်ဆေးအဖြစ် အသုံးပြုမည် ဆိုပါက သွားယို့ယွင်းပျက်စီးမှုမှ ကာကွယိနိုင်ပါသည်။ ပြင်းအား အရမ်းများပါက ဖလိုရင်း ဓာတ်ငွေ့သည် သေစေနိုင်သောကြောင့် ၎င်းဓာတ်ငွေ့သည် အန္တရယ်ရှိနိုင်ပါသည်။ ပြင်းအားနည်းလျှင် မျက်လုံးနှင့် နှာခေါင်းတို့ကို ကျိန်းစပ်စေနိုင်ပါသည်။
ပတ်ဝန်းကျင်သို့ သက်ရောက်မှုများ
ဖလိုရင်းသည် မြေဆီလွှာများတွင် တည်ရှိပြီးအပင်များတွင် စုပြုံနေတတ်သည်။ မြေဆီလွှာတွင် တွေ့ရသော ဖလိုရင်းအမျိုးအစား၊ ပမာဏနှင့် မြေဆီလွှာ အမျိုးအစား၊ အပင်အမျိုးအစားများ အပေါ်မှုတည်ပြီး ပမာဏအနည်းအများဖြင့် အသုံးပြုနိုင်ပါသည်။ တိရစ္ဆာန်များသည် ဖလိုရင်းရှိသောအပင်များကို စားသုံးလိုက်သောအခါတွင် ၎င်းတို့၏ ခန္ဒာကိုယ်ထဲတွင် ပြင်းအားကြီးမားသော ဖလိုရင်းများကို စုဆောင်းမိလာနိုင်သည်။ အရိုးထဲတွင် ဖလိုရင်းကို ပထမဆုံး စုဆောင်းမိလာနိုင်သည်။ ထို့ကြောင့် ဖလိုရင်းပြင်းအားများသည် များပြားလာပြီး အရိုးများ၊ သွားများကို ပျက်စီးသည် ကိုတွေ့ရပါသည်။
ဓာတ်ပုံများ
.jpg.webp) စီးပွားဖြစ်ထုတ်လုပ်ရာတွင် ဖလိုရင်းရှိသည့် ဖလိုရိုက်မင်နာရယ် ပုံဆောင်ခဲများ
စီးပွားဖြစ်ထုတ်လုပ်ရာတွင် ဖလိုရင်းရှိသည့် ဖလိုရိုက်မင်နာရယ် ပုံဆောင်ခဲများ တွေ့ရှိသူ ဟန်ရီ မွိုင့်စန်
တွေ့ရှိသူ ဟန်ရီ မွိုင့်စန် ဖလိုရင်းထုတ်လုပ်သည့် F 2 ဓာတုဗေဒ လိမိတက်၊ ဖလိုရင်းဆဲ အခန်း၊ ပဲရစ္စတန်၊ ယူကေ
ဖလိုရင်းထုတ်လုပ်သည့် F 2 ဓာတုဗေဒ လိမိတက်၊ ဖလိုရင်းဆဲ အခန်း၊ ပဲရစ္စတန်၊ ယူကေ အိုင်အိုဒင်း ဟပ်တာဖလိုရိုက်နှင့် ရေနီယမ် ဟပ်တာဖလိုရိုက် အသစ်၊
အိုင်အိုဒင်း ဟပ်တာဖလိုရိုက်နှင့် ရေနီယမ် ဟပ်တာဖလိုရိုက် အသစ်၊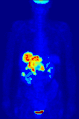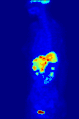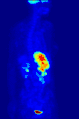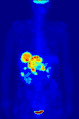 ခန္ဓာပြည့် စမ်းသပ်မှုတွင် ဖလိုရင်း ၁၈ ကို အသုံးပြုသည်။
ခန္ဓာပြည့် စမ်းသပ်မှုတွင် ဖလိုရင်း ၁၈ ကို အသုံးပြုသည်။ ဖလိုရင်းကြော်
ဖလိုရင်းကြော်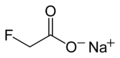 ဆိုဒီယမ် ဖလိုရာအက်စ်တက် တွင် သဘာအလျောက် ဖြစ်ပေါ်နေသော အဆိပ်ကို အချိုအပင်များတွင် တွေ့ရ
ဆိုဒီယမ် ဖလိုရာအက်စ်တက် တွင် သဘာအလျောက် ဖြစ်ပေါ်နေသော အဆိပ်ကို အချိုအပင်များတွင် တွေ့ရ အပူချိန်နည်းသော အခြေအနေရှိ ဖလိုရင်းငွေ့ရည်
အပူချိန်နည်းသော အခြေအနေရှိ ဖလိုရင်းငွေ့ရည်
ကိုးကား
- 2013 Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
- Jaccaud et al. 2000, p. 381.
- Haynes 2011, p. 4.121.
- Jaccaud et al. 2000, p. 382.
- Compressed Gas Association 1999, p. 365.
- Dean 1999, p. 4.6.
- Dean 1999, p. 4.35.
- Matsui 2006, p. 257.
- Yaws & Braker 2001, p. 385.
- Mackay, Mackay & Henderson 2002, p. 72.
- Cheng et al. 1999.
- Chisté & Bé 2011.