ကြွပ်
ကြွပ် (အင်္ဂလိပ်: Bismuth) သည် အဖြူရောင် ပုံဆောင်ခဲရှိပြီး ပန်းရောင်ဖျော့ဖျော့ ရောနှောသည့် ပြင် အနီရောင်အနည်းငယ် သန်းနေသော ကြွတ်ဆတ်မာကျောသော သတ္တုအမျိုးအစားဖြစ်သည်။ ၎င်းကို အင်္ဂလိပ်ဘာသာဖြင့် Bismuth ဟုခေါ်သည်။ ဓာတုသင်္ကေတမှာ Bi ဖြစ်သည်။ မြန်မာအခေါ်မှာ ကြွပ် ဖြစ်သည်။ ဘစ်စမတ်သည် သတ္တုအားလုံးထဲတွင် သံလိုက်သတ္တိအကြွဆုံးသော သတ္တုဖြစ်ပြီး ပြဒါးမှ လွဲ၍ အခြားသော သတ္တုများထက် အပူလျှောက်ကူးမှု အနည်းဆုံးဖြစ်သည်။ လျှပ်ကာမှု မြင့်မားပြီး သံလိုက်စက်ကွင်းအတွင်း လျှပ်ကာမှု အမြင့်မားဆုံး သတ္တုဖြစ်သည်။ ဘစ်စမတ်သည် အောက်ဆီဂျင်၊ ရေတို့နှင့် ဓာတ်ပြုမှုရှိသော်လည်း နိုက်ထရစ်အက်ဆစ်ပြင်းနှင့် လေထဲတွင် ဓာတ်ပြုပါက အရည်ပျော်သွားသည်။ ရေထဲတွင် ရှိသောအချိန်၌ ဘစ်စမတ်ဆားများအားလုံးသည် အရည်မပျော်နိုင်သော ကွန်ပေါင်းများဖြစ်ကြပါသည်။ ကြွပ် (ဘစ်စမတ်)၏ အက်တမ်အမှတ်မှာ ၈၃၊ အက်တမ်အလေးဆမှာ ၂၀၈ ကျော်ကျော် ဖြစ်သည်။
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ယေဘုယျ ဂုဏ်သတ္တိများ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| အမည်၊ သင်္ကေတ | ကြွပ်, Bi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အသံထွက် | /ˈbɪzməθ/ BIZ-məth | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အဆင်း | lustrous brownish silver | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဒြပ်စင်အလှည့်ကျဇယားရှိ ကြွပ် | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အက်တမ် အမှတ်စဉ် (Z) | 83 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အုပ်စု၊ ဘလော့ | group 15 (pnictogens), p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဒြပ်စင်အလှည့်ကျဇယား | period 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဒြပ်စင် ကဏ္ဍ | post-transition metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| စံ အက်တောမစ် အလေးချိန် (±) (Ar) | 208.98040(1)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အီလက်ထရွန် ပြုပြင်မှု | [Xe] 4f14 5d10 6s2 6p3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အခွံတစ်ခုလျင် အီလက်ထရွန်ပါဝင်မှု | 2, 8, 18, 32, 18, 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ရုပ်ပိုင်းဆိုင်ရာ ဂုဏ်သတ္တိများ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဖေ့စ် | အစိုင်အခဲ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အရည်ပျော်မှတ် | 544.7 K (271.5 °C, 520.7 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အရည်ဆူမှတ် | 1837 K (1564 °C, 2847 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| သိပ်သည်းမှု (အခန်းအပူချိန်) | 9.78 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.05 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဖျူးရှင်းအပူ | 11.30 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အငွေ့ပျံခြင်း အပူ | 179 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| မိုလာ အပူအင်အား | 25.52 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ငွေ့ရည်ဖိအား
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အက်တောမစ် ဂုဏ်အင်များ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အောက်ဆိုဒ်ဒေးရှင်း အခြေနေ | 5, 4, 3, 2, 1, −1, −2, −3 (a mildly acidic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အီလက်ထရွန် ဆန့်ကျင်ဘက်ဓာတ် | Pauling scale: 2.02 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အိုင်ယွန်းပြုခြင်းစွမ်းအင် | 1st: 703 kJ/mol 2nd: 1610 kJ/mol 3rd: 2466 kJ/mol (more) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အက်တောမစ် အချင်းဝက် | empirical: 156 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ကိုဗေးလန့်အချင်းဝက် | 148±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဗန်ဒါဝေါ့စ် အချင်းဝက် | 207 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ပုံဆောင်ခဲ ဖွဲ့စည်းပုံ | rhombohedral[2]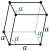 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အသံ၏အမြန်နှုန်း | 1790 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အပူ ပြန့်ကားမှု | 13.4 µm/(m·K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အပူစီးကူးမှု | 7.97 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| လျှပ်စစ် ခုခံမှု | 1.29 µΩ·m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| သံလိုက်ဓာတ် | diamagnetism | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| သံလိုက် ထိတွေ့နိုင်မှု (χmol) | −280.1·10−6 cm3/mol[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young's modulus | 32 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 12 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 31 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ပိုင်ဆွန် အချိုး | 0.33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 2.25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 70–95 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-69-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| သမိုင်းကြောင်း | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ရှာဖွေတွေ့ရှိမှု | Claude François Geoffroy (1753) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Most stable isotopes of ကြွပ် | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
အသုံးပြုခြင်း
ကြွပ် (ဘစ်စမတ်) အစစ်သည် ခဲထက်မာ၍ ရေထက် ၉.၉ ဆ လေး၏။ ၅၂ဝ ဒီဂရီဖာရင်ဟိုက်၌ အရည်ပျော်သည်။ သတ္တုအပေါင်းတွင် အပူလိုက် အညံ့ဆုံးဖြစ်သည်။ ဤသတ္တုကို စက္ကူမာပေါ်တွင် တင်၍ ဖယောင်းတိုင်မီး သို့မဟုတ် မှန်မီးအိမ်ဖြင့် စက္ကူ အောက်၌ မြှိုက်ပေးလျှင် စက္ကူမီးမလောင်မီ အရည်ပျော်သွား သည်။ အခြားသတ္တုများနှင့် ကြွပ်ကို ရောစပ်လိုက်သောအခါ အရည်ပျော်လွယ်သော သတ္တုစပ်များကို ရသည်။ ဥပမာအား ဖြင့် ကြွပ် ၄ ဆ၊ ခဲပုပ် ၂ ဆ၊ သံဖြူ ၁ ဆနှင့် ကယ်ဒမီယမ် ၁ ဆ ရောစပ်ယူသောအခါ ဝုသတ္တုကို ရသည်။ ရေဒီယိုပေါ် ခါစက အသံဖမ်းခွက်တွင် ခရစ္စတယ်တို ဂဟေဆော်ယူသော အခါ ဤသတ္တုစပ်ကို အသုံးပြုလေသည်။ ဤသတ္တုသည် အပူချိန် ၁၅၈ ဒီဂရီဖာရင်ဟိုက် သို့မဟုတ် ရေဆူအပူချိန် ၂/၃ ခန့်တွင် အရည်ပျော်သဖြင့် အသံဖမ်းခွက်၌ ခရစ္စတယ်ကို မပျက်စီးဘဲ ဂဟေဆော်နိုင်သည်။ ကြွပ်သတ္တုစပ်များကို အသုံး ပြုပုံ တစ်မျိုးမှာ အလိုအလျောက် ရေပက်ဖျန်းသည့် ပိုက်ခေါင်း များတွင် ပိုက်ခေါင်းထိပ်ဖုံးအဖြစ် သုံးစွဲခြင်း ဖြစ်သည်။ ကုန်လှောင်ရုံများ၌ မီးစွဲလောင်သောအခါ ထိုသတ္တုစပ်ဖြင့် လုပ်ထားသော ပိုက်ခေါင်းသည် အရည်ပျော်၍ အလိုလိုပွင့် ထွက်သွားသည်။ ထိုအခါ ရေသည် ပန်းထွက်လာ၍ မီးလောင် သောနေရာကို ပက်ဖျန်းပေးသည်။ အစွန်းခံသံမဏိတွင် ကြွပ် ဝ.၁ ရာခိုင်နှုန်းမှ ဝ.၅ ရာခိုင်နှုန်းအထိ ရောစပ်ထားသည်။ ဘစ်မတ်ဒြဗ်ပေါင်းများကို အစာမကြေ ဝမ်းဖောဝမ်းရောင် ရောဂါ ကုသရာ၌ အသုံးပြုသည်။ အိပ်စရေးရောင်ခြည်သည် ဘစ်မတ်ဓာတ်ဆားအချို့ကို ဖြတ်သန်းမသွားနိုင်ပေ။ ထို့ကြောင့် လူနာတစ်ဦးတစ်ယောက်၏ အစာကြောင်းကို စစ်ဆေးကြည့်ရှု လိုလျှင် ထိုလူနာအား အစာကျွေးသောအခါ ဘစ်စမတ် ဓာတ် ဆားဖြင့် ရော၍ကျွေးသည်။ ထို့နောက် အစာအိမ်နှင့် အူသိမ် အတွင်း၌ အစာသွားလမ်းကို ဓာတ်မှန်ရိုက်၍ စစ်ဆေးကြည့်ရှု လေသည်။
ခြည်ထည်များကို အပွင့်ရိုက်ရာတွင်လည်း ဘစ်စမတ်ဓာတ်ဆားများကို အသုံးပြုကြ သည်။ ပိုးသတ်ဆေး၊ ဖန်ထည်ကြွေထည်သုတ်ဆေး စသည်တို့ကို ပြုလုပ်ရာ၌လည်း ဘစ်မမတ်ဓာတ်ဆားများကို သုံးရသည်။ ဝမ်းကျရောဂါဆေးဖြစ်သည့် မစ်အော့ဘစ်စမတ်သည် ဒြဗ်ပေါင်း တစ်မျိုး ဖြစ်သည်။[4]
ဘစ်စမတ်သတ္တုကို အရည်ပျော်မှုနည်းပါးသော ဆော်ဒါများ ထုတ်လုပ်ရာတွင်လည်းကောင်း၊ ငှက်ဖမ်းပိုက်၊ ငါးဖမ်းပိုက်များတွင် အသုံးပြုသော ခဲသီးများကဲ့သို့ သတ္တုစပ်များ ပြုလုပ်ရာတွင်လည်းကောင်း အသုံးပြုပါသည်။ ဆေးဝါးထုတ်လုပ်မှုနှင့် သုံးစွဲမှုများတွင် ဘစ်စမတ်ကွန်ပေါင်းများကို သုံးစွဲလေ့ရှိကြပါသည်။ ရော်ဘာနှင့် ပလပ်စတစ်များ ထုတ်လုပ်ခြင်းတွင် အသုံးပြုသော ဓာတ်ကူပစ္စည်းများအတွက် ဘစ်စမတ်ကွန်ပေါင်းများကို အသုံးပြုကြသည်။ ဘစ်စမတ်ကို ပစ်ခတ်ခြင်းအတွက် သေနတ်များတွင် အနည်းငယ်အသုံးပြုကြသေးသည်။
ပတ်ဝန်းကျင်တွင် တွေ့ရှိရမှု
ဘစ်စမတ်၏ အဓိကအရေးကြီးသော သတ္တုရိုင်းများမှာ (bismuthimite)( Bi2S3)နှင့် (bismite)( Bi2O3) တို့ဖြစ်ကြသည်။ ဘစ်စမတ်ကို သဘာဝသတ္တုအတိုင်း ပုံဆောင်ခဲအနေဖြင့် နီကယ်လ်၊ ကိုဘော့၊ ငွေနှင့် သံတို့၏ ဆာလဖိုဒ် သတ္တုရိုင်းများတွင် တွေ့ရှိနိုင်ပါသည်။ ဘစ်စမတ်၏ အဓိက ထုတ်လုပ်ကုန်မှာ အထူးသဖြင့် အမေရိကန်နိုင်ငံတွင် ခဲနှင့် ကြေးနီရောစပ်မှု ပြုလုပ်ရာတွင် အသုံးပြုခြင်းဖြစ်ပါသည်။ ၎င်းကို အဓိကအများဆုံး တွေ့ရှိနိုင်သော ဒေသများမှာ ဗိုလီဗီးယား၊ ပီရူး၊ ဂျပန်၊ မက္ကဆီကိုနှင့် ဆာနာဒါနိုင်ငံတို့ ဖြစ်ကြသည်။ ထို့ပြင် သတ္တုသန့်သန့်ကို အင်္ဂလန်ပြည် ဆက်စွန်နီ နယ်နှင့် နော်ဝေးနိုင်ငံတို့တွင် အနည်းငယ်ခန့် တွေ့ရသည်။
ကျန်းမာရေးဆိုင်ရာအကျိုးသက်ရောက်မှုများ
ဘစ်စမတ်နှင့် ၎င်း၏ ဆားများသည် ကျောက်ကပ်ကို ထိခိုက်စေနိုင်ပါသည်။ ၎င်း၏ ပမာဏအနည်းအများပေါ်မူတည်၍ ထိခိုက်မှု အနည်းအများရှိနိုင်ပြီး လူကို ထိခိုက်စေသော ပမာဏများပြားပါက သေဆုံးသည်အထိ ဖြစ်စေနိုင်ပါသည်။ ထို့ကြောင့် စက်မှုလုပ်ငန်းများတွင် ဘစ်စမတ်ကို Heavy Metals သတ္တုအမျိုးအစားများထဲမှ အဆိပ်ဓာတ်နည်းသော သတ္တုတစ်ခုအဖြစ် သတ်မှတ်ထားကြသည်။ မြောက်မြားစွာသော ဘစ်စမတ်ပမာဏကို အလုံပိတ် အခန်းငယ်လေးများအတွင်း ထိုးသွင်းခြင်းနှင့် ဘစ်စမတ်ကို လောင်ကျွမ်းစေခြင်းဖြင့် တွင်ကျယ်စွာ အသုံးပြုသော လုပ်ငန်းများကြောင့် အလွန်ပြင်းထန်ပြီး သေစေနိုင်သည်အထိ အဆိပ်အတောက်ဖြစ်စေမှုကို ဖြစ်ပေါ်စေပါသည် (ပျော်ဝင်နိုင်သော ဘစ်စမတ်ဒြပ်ပေါင်းအနေဖြင့်သာ)။ ၎င်းဒြပ်စင်သည် အခြားများစွာသော အဆိပ်ရောဂါများကိုလည်း ဖြစ်ပွားစေပါသည်။ ဥပမာ။ ။ခန္ဓာကိုယ် မအီမသာလေးလံထိုင်းမှိုင်းခြင်း၊ ဝမ်းလျှော်ခြင်း၊ အရေအပြား နီရဲယားယံခြင်း ကဲ့သို့သော ရောဂါများကို ဖြစ်ပွားစေပါသည်။
ဝင်ရောက်နိုင်သောလမ်းကြောင်းများ
ရှူရှိုက်မိခြင်း၊ သောက်သုံးမိခြင်း(မျိုချခြင်း)နှင့် အရေပြားမှတဆင့် ဝင်ရောက်ခြင်း စသည်တို့ဖြစ်သည်။ ထူးခြားသော သက်ရောက်မှုမှာ ဘစ်စမတ်အမှုန်များသည် အသက်ရှူလမ်းကြောင်းကို ကျိန်းစပ်စေနိုင်ပါသည်။ အသက်ရှူလမ်းကြောင်းနံရံများတွင် သတ္တုချိုးများ ကပ်နေတတ်သဖြင့် အသက်ရှူမှုကို ဆိုးရွားစေနိုင်သည်။ ခန္ဓာကိုယ်အတွင်း ရောက်ရှိခြင်း သို့မဟုတ် သောက်သုံးမိခြင်းဖြင့် စိတ်မအီမသာ ဖြစ်ခြင်း၊ ကိုယ်လက်မအီမသာဖြစ်ခြင်း၊ စားသောက်ချင်စိတ် မရှိခြင်း၊ အရေပြားယားယံခြင်း၊ အစာအိမ် ရောဂါဖြစ်ပွားခြင်း၊ စိုးရိမ်စိတ် များပြားခြင်း၊ အိပ်မပျော်ခြင်း၊ စိတ်အားငယ်ခြင်း၊ စိတ်ကျရောဂါဖြစ်ခြင်း၊ မျက်စိထဲသို့ ဝင်ပါက ကျိန်းစပ်ခြင်းဖြစ်ပြီး အရေပြားနှင့် ထိတွေ့ပါက စပ်ဖျင်းဖျင်းဝေဒနာကို ခံစားရတတ်ပါသည်။
နာတာရှည် အကျိုးသက်ရောက်မှုများ
ရှူရှိုက်ခြင်းဖြင့် အဆုတ်နှင့်အသည်းကို ထိခိုက်စေနိုင်ပါသည်။ မျိုချမိပါက အဆုတ်နှင့် အသည်း ထိခိုက်မှုများ ဖြစ်နိုင်သည့်အပြင် သွေးအားနည်းရောဂါ(ဖျော့တော့နာ)နှင့် အစာအိမ် ပြည်တည်နာ စသည်တို့ကိုလည်း ဖြစ်စေနိုင်ပါသည်။ အရည်ပြားတွင် ထိတွေ့မိပါက အရေပြားနီ၍ ရောင်အမ်းနာကျင်ခြင်းကို ခံစားရမည်ဖြစ်ပါသည်။ သို့သော် ကင်ဆာရောဂါ မဖြစ်စေနိုင်ပါ။
ပတ်ဝန်ကျင်သို့ အကျိုးသက်ရောက်မှု
ဘစ်စမတ်ကို အဆိပ်ပြင်းသော သတ္တုအဖြစ် မသတ်မှတ်ထားပါ။ ၎င်းသည် ပတ်ဝန်းကျင်ကို ဆိုးကျိုးသက်ရောက်မှု နည်းပါးပါသည်။ ၎င်းကွန်ပေါင်းများသည် ပျမ်းမျှအားဖြင့် ပျော်ဝင်မှု နည်းပါးသော ဒြပ်ပေါင်းအမျိုးအစားများ ဖြစ်သော်လည်း ၎င်း၏ ပတ်ဝန်းကျင်သို့ သက်ရောက်နိုင်မှုနှင့် ပတ်ဝန်းကျင်တွင် တည်ရှိနေမှုဆိုင်ရာ အချက်အလက်များကို တိကျစွာ မသိရှိနိုင်သေးသောကြောင့် သတိထားကိုင်တွယ်ရမည့် သတ္တုအမျိုးအစား တစ်ခုဖြစ်ပါသည်။
ကိုးကား
- Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
- "The crystal structure of Bi and of solid solutions of Pb, Sn, Sb and Te in Bi" (1962). Acta Crystallographica 15 (9): 865. doi:.
- Weast၊ Robert (1984)။ CRC, Handbook of Chemistry and Physics။ Boca Raton, Florida: Chemical Rubber Company Publishing။ pp. E110။ ISBN 0-8493-0464-4။
- မြန်မာ့စွယ်စုံကျမ်း၊ အတွဲ(၂)