ပိုလိုနီယမ်
ပိုလိုနီယမ် (အင်္ဂလိပ်: Polonium) (ဓာတုသင်္ကေတ- Po)သည် ရေဒီယိုသတ္တိကြွ ဒြပ်စင်တစ်ခုဖြစ်ပြီး အလွန်ရှားပါးသော semi-metal ဖြစ်သည်။ ၎င်းသည် တုံ့ပြန်မှုအားကောင်းပြီး ငွေမှင်ရောင်ရှိသည်။ အက်စစ်ပျော့များတွင် ကောင်းမွန်စွာ ပျော်ဝင်နိုင်သော်လည်း အယ်လ်ကာလီ (alkalis)များ တွင်မူအနည်းငယ်မျှသာလျှင် ပျော်ဝင်နိုင်သည်။ ၎င်း သည် အသင့်အတင့် အငွေ့ပျံနိုင်သည်။ ၎င်းဒြပ်စင်ပါဝင်သောပျော်ရည်များသည် (အလုံပိတ်ထားသော ခွက်ထဲတွင် သိမ်းဆည်းထားခြင်းမရှိလျှင်) ၃ ရက်လျှင် တစ်ဝက်ခန့် အငွေ့ပျံသွားနိုင်သည်။
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ယေဘုယျ ဂုဏ်သတ္တိများ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| အမည်၊ သင်္ကေတ | ပိုလိုနီယမ်, Po | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အသံထွက် | /poʊˈloʊniəm/ po-LOH-nee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အော်လိုထရိုဖီ | α, β | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အဆင်း | silvery | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဒြပ်စင်အလှည့်ကျဇယားရှိ ပိုလိုနီယမ် | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အက်တမ် အမှတ်စဉ် (Z) | 84 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အုပ်စု၊ ဘလော့ | group 16 (chalcogens), p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဒြပ်စင်အလှည့်ကျဇယား | period 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဒြပ်စင် ကဏ္ဍ | post-transition metal, but this status is disputed | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| စံ အက်တောမစ် အလေးချိန် (Ar) | (209) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အီလက်ထရွန် ပြုပြင်မှု | [Xe] 4f14 5d10 6s2 6p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အခွံတစ်ခုလျင် အီလက်ထရွန်ပါဝင်မှု | 2, 8, 18, 32, 18, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ရုပ်ပိုင်းဆိုင်ရာ ဂုဏ်သတ္တိများ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဖေ့စ် | အစိုင်အခဲ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အရည်ပျော်မှတ် | 527 K (254 °C, 489 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အရည်ဆူမှတ် | 1235 K (962 °C, 1764 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| သိပ်သည်းမှု (အခန်းအပူချိန်) | alpha: 9.196 g/cm3 beta: 9.398 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဖျူးရှင်းအပူ | ca. 13 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အငွေ့ပျံခြင်း အပူ | 102.91 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| မိုလာ အပူအင်အား | 26.4 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ငွေ့ရည်ဖိအား
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အက်တောမစ် ဂုဏ်အင်များ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အောက်ဆိုဒ်ဒေးရှင်း အခြေနေ | 6, 5,[1] 4, 2, −2 (an amphoterism oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အီလက်ထရွန် ဆန့်ကျင်ဘက်ဓာတ် | Pauling scale: 2.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အိုင်ယွန်းပြုခြင်းစွမ်းအင် | 1st: 812.1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အက်တောမစ် အချင်းဝက် | empirical: 168 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ကိုဗေးလန့်အချင်းဝက် | 140±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ဗန်ဒါဝေါ့စ် အချင်းဝက် | 197 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ပုံဆောင်ခဲ ဖွဲ့စည်းပုံ | cubic α-Po | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ပုံဆောင်ခဲ ဖွဲ့စည်းပုံ | rhombohedral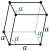 β-Po | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အပူ ပြန့်ကားမှု | 23.5 µm/(m·K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အပူစီးကူးမှု | 20 W/(m·K) (?) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| လျှပ်စစ် ခုခံမှု | α: 0.40 µΩ·m (at 0 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| သံလိုက်ဓာတ် | nonmagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-08-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| သမိုင်းကြောင်း | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| အမည်တပ်ခြင်း | after Polonia, Latin for Poland, homeland of Marie Curie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ရှာဖွေတွေ့ရှိမှု | Pierre Curie and Marie Curie (1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ပထမဆုံး ခွဲထုတ်မှု | Willy Marckwald (1902) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Most stable isotopes of ပိုလိုနီယမ် | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
အသုံးပြုခြင်း
ပိုလိုနီယမ်(Polonium) အားအထည်အလိပ်စက်ရုံများတွင်(မစီးဆင်းနိုင်သောလျှပ်စစ်ဓာတ်အားများကိုဖယ်ရှားရန်) လည်းကောင်း၊ ကင်မရာများတွင်ထည့်သွင်း အသုံးပြုသည့် ပုံရိပ်စွဲထင်စေရန်အလင်းရောင်နှင့်ဓာတ်ပြုသော ဓာတုပစ္စည်း လိမ်းကျံထားသည့်မှန်ပြား များပြုလုပ်သောနေရာများတွင် (စုဆောင်းမိနေသည့် ဖုန်မှုန့်များကို ဖယ်ရှားသည့် (brushes) များဖြစ်) လည်းကောင်း အသုံးပြုခဲ့ကြသည်။ ၎င်းဒြပ်စင်ကို အယ်ဖာ(alfa) ရောင်ခြည် ဖြာထွက်ခြင်းအား လေ့လာသော သုသေသနလုပ်ငန်းများအတွက် အဓိက အရင်းအမြစ် အဖြစ်လည်းကောင်း၊ ဘီလယ်လီယမ် (beryllium) ဒြပ်စင်နှင့်ရောစပ်၍ သတ္တုစပ် (alloyed)ပြုလုပ်ပြီး အနုမြူစွမ်းအင်သုံးဓာတ်ပေါင်းဖိုများတွင် နျူထရွန်များကို အလွယ်တစ်ကူ သယ်ဆောင်ပေးနိုင်သော အဓိကအရင်းအမြစ်အဖြစ် အသုံးပြုလျှက်ရှိသည်။
သဘာဝမှာတွေ့ရှိမှုအခြေအနေ
သဘာဝတွင် ပိုလိုနီယမ်(Polonium) သည် အလွန်ရှားပါးသောဒြပ်စင်ဖြစ်သည်။ ၎င်းကို ယူရေနီယမ် သတ္တုရိုင်းများတွင် တွေ့ရှိရသော်လည်း ၎င်းကို သီးသန့် သတ္တုရိုင်းပုံစံအဖြစ် မထုတ်လုပ်နိုင်ပေ။ အဏုမြူ ဓာတ်ပေါင်းဖို များအတွင်း ဘစ်တမက် (bismuth) ဒြပ်စင်ကို နျူထရွန်များ နှင့် ပစ်ပေါက်ဖြိုခွဲခြင်းအားဖြင့် polonium ဒြပ်စင်ကို တစ်နှစ်လျှင် ၁၀၀ ဂရမ်ဝန်ကျင်ခန့် ထုတ်လုပ်လျှက်ရှိသည်။
ကျန်းမာရေးဆိုင်ရာ သက်ရောက်မှုများ
Polonium-210 သည် စီးကရက်ဆေးလိပ်၏ အစိတ်အပိုင်းဖြစ်၍ ၎င်းကိုယ်တိုင် ကင်ဆာရောဂါ ကို ဖြစ်ပွါးစေသည်။ အလွန်အကျွံ ဆေးလိပ်သောက်သုံးသူများတွင် polonium ပါဝင်မှု ပမာဏထက် ၅ ဆ ခန့် လျော့ချ၍ ဓာတ်ခွဲခန်းတိရိစ္ဆာန်များကို ရှူရှိုက်စေရုံမျှဖြင့် အသားပိုများ ရောင်ရမ်းထွက်ခြင်း(tumors) ကဲ့သို့သော ရောဂါကိုဖြစ်စေသည်။လူများအကြား အဆုပ်ကင်ဆာ ဖြစ်ပွားနှုန်းသည် အစဉ်မြင့်တက် လျှက်ရှိပြီး ၁၉၃၀ ခုနှစ်မှစ၍ တစ်နှစ်လျှင် လူ (၁၀၀) ဦး တွင် (၄) ဦး သာရှိခဲ့ရာမှ ကမ္ဘာ့အဆင့်တစ် လူသတ်ရောဂါအဖြစ် ၁၉၈၀တွင် ရောက်ရှိခဲ့သည်။ ဆေးလိပ် သောက်သုံးခြင်းအား ၂၀ ရာခိုင်နှုန်းလုနီးပါး လျှော့ချနိုင်ခဲ့သော်လည်း လူ (၁၀၀) ဦး တွင် (၇၂) ဦး အထိဆက်လက်မြင့်တက်လျှက်ရှိသည်။ သို့သော် ထိုကာလအတွင်းမှာပင် အမေရိကန်နိုင်ငံတွင် polonium-210 ပါဝင်သော ဆေးရွက်ကြီးထုတ်လုပ်မှု အဆင့်သည် ၃ ဆတိုးခဲ့သည်။ ထို့ကြောင့် ဆေးရွက်ကြီးစိုက်ပျိုးသူများသည်ဆေးရွက်ကြီးအထွက်တိုးစေရန် ဖော့စဖိတ် ဓာတ်မြေဩဇာ(phosphate fertilizers)အသုံးပြုမှုပိုများလာသည်။ မြေဩဇာတွင် calcium phosphate များလာခြင်းနှင့်အတူ ယူရေနီယမ်ဒြပ်စင်အဖြစ်သို့ ပြောင်းလည်း စုပုံရောက်ရှိလာပြီး ရေဒွန် ဓာတ်ငွေ့များ ပျံ့နှံ့ခြင်းကိုဖြစ်ပေါ်လာစေသည်။ ရေဒွန်ဒြပ်စင် ယိုယွင်းပျက်စီးခြင်းသည် လျှပ်စစ် စီးဆင်းမှုပုံစံမျိုးပင်ဖြစ်သောကြောင့် ၎င်းနှင့်ထိတွေ့မိသော ဖုန်မှုန့်များအတွင်းသို့ လျှပ်စီးမှုများဖြစ်ပေါ်စေပြီး ထိုဖုန်မှုန့်များသည် ဆေးရွက်ကြီးရွက်များ၏ အောက်ဖက်ရှိ စေးကပ်သောအမွှေးများပေါ်သို့ တွယ်ကပ် နေကြသည်။ ထို့နည်းအားဖြင့် ရေဒီယိုသတ္တိကြွနေသော ပိုလိုနီယမ်(Polonium) နှင့် lead ဒြပ်စင်တို့သည် ဆေးရွက်ကြီးရွက်များပေါ်သို့ ရောက်ရှိသွားကြသည်။ ထိုနောက် စီးကရက်၏ထိပ်ဖျားအား မီးနှင့် လောင်ကျွမ်းစေသောအခါ ၎င်းရေဒီယိုသတ္တိကြွနေသော ဒြပ်စင်များသည် အငွေ့အဖြစ်သို့ ရောက်ရှိ သွားကြသည်။ ၎င်း ရေဒီယိုသတ္တိကြွနေသောအငွေ့များသည် စီးကရက်အစီခံနှင့် ထိတွေ့စဉ်တွင် ကင်ဆာရောဂါကိုဖြစ်စေသော ကာဆီနိုဂျင်(carcinogens)များကို စစ်ထုတ်နိုင် သောကြောင့် ပြင်းထန်စွာ မထိရောက်နိုင်ဘဲ တဖန်လေထုထဲသို့ ရေဒီယိုသတ္တိကြွနေသောအငွေ့များ အဖြစ်ပင်ပြန်လည် ရောက် ရှိသွားကြသည်။ကြာရှည်စွာဆေးလိပ်သောက်သူတစ်ဦး၏အဆုပ်သည် ရေဒွန်ဒြပ်စင်မှ ဖြစ်ပေါ်သော ရေဒီယိုသတ္တိကြွမှုထက် (ပြင်းအားပမာဏပိုမိုများပြားသော ) ရေဒီယိုသတ္တိကြဓာတ်ရောင်ခြည်လိုင်းများ ထိသင့်ကို ပိုမိုခံစားကြရသည်။ ထိုသို့ဖြစ်ရခြင်းမှာ ဆေးရွက်ကြီးအောက်ဖက်တွင် တွယ်ကပ်နေသောအမှုန်များမှ ရေဒီယိုသတ္တိကြွဓာတ်ရောင်ခြည်များ ထုတ်လွတ်ခြင်းကြောင့်ဖြစ်သည်။ တစ်နေ့လျှင်ဆေးလိပ် နှစ်ဘူးမျှပုံမှန်သောက်သုံးခြင်းဖြစ် တစ်နှစ်လျှင် ၁.၃၀၀ မီလီရမ် ခန့်ရှိသည့် (အယ်လ်ဖာ(alpha) ရောင်ခြည်မှုန်များဖြာထွက်ခြင်းကြောင့် ဖြစ်ပေါ်လာသော ) ရေဒီယိုသတ္တိကြွဓာတ်ရောင်ခြည်သင့်မှု ပမာဏ ကိုဝင်ရောက်စေနိုင်သည်။ နှိုင်းယှဉ်ချက်များအရ အမေရိကန်နိုင်ငံတွင် ရေဒွန်ဓာတ်ငွေ့ ရှူရှိက်မိခြင်းကြောင့် ရေဒီယိုသတ္တိကြွ ဓာတ်ရောင်ခြည်သင့်မှု ခံစားရသောပမာဏမှာ တစ်နှစ်လျှင် ပျမ်းမျှ 200 mrem ခန့်ရှိသည်။ (mrem, မီလီရမ် – လူ့ကိုယ်ပေါ်သို့ ဓာတ်ရောင်ခြည် ဝင်ရောက်မှု ပမာဏအား တိုင်းတာသောယူနစ်) ။ သို့သော် တစ်နေ့လျှင်စီးကရက် ၁၀ လိပ် မျှသောက်ခြင်းဖြစ်လည်း ရေဒွန်ဓာတ်ငွေ့မှ ရေဒီယိုသတ္တိကြွဓာတ်ရောင်ခြည်သင့်မှု ပမာဏ “သက်ရောက်မူအဆင့်” “action level” 4 pCi/L နှင့်တူညီသော ပမာဏကို ဖြစ်ပေါ်စေသည်။ polonium-210 သည်သာမာန်ရေဒွန်ဒြပ်စင်ထက် အဆပေါင်းများစွာ ခန္ဓာကိုယ်ကိုဖြတ်သန်းသွားနိုင်ပြီး ကလာပ်စည်းများ နှင့် ဆဲလ်များဆီသို့ ပျော်ဝင်သွားကာ အဆင့်ဆင့်ပျံ့နှံ့နိုင်ခြင်းရှိသည်။ polonium-210 ပျံ့နှံ့ရောက်ရှိခြင်းကြောင့် မျိုးရိုးဗီဇဆိုင်ရာများပျက်စီးခြင်းကို ဖြစ်ပေါ်စေနိုင်သည်။ ရေဒီယို ရောင်ခြည် သင့်မှုကြောင့်ဖြစ်ပေါ်တတ်သော ရောဂါများမှာ အသည်းနှင့်ဆီးအိမ် ကင်ဆာ၊ အစာအိမ် ဖက်ခွက်နာ၊ နှလုံးနှင့်သွေးကြောများအတွင်းနာဖြစ်ခြင်း(cardiovascular diseses)၊ အသည်းရွတ်ရောဂါ နှင့် သွေးကင်ဆာ ရောဂါတို့ဖြစ်သည်။ အထွေထွေခွဲစိတ်ကုသမှုဆရာဝန် C.Everett Koop က ဆေးလိပ် သောက်ခြင်းကြောင့်ဖြစ်သော အဆုပ်ကင်ဆာသမားအားလုံး၏ အနည်းဆုံးပမာဏ ၉၀% ခန့်သည် ဓာတ်ရောင်ခြည်သင့်မှုကြောင့် ဖြစ်ကြောင်း အတည်အတိအကျဖော်ပြခဲ့သည်။ အမေရိကန်နိုင်ငံသည် ဆေးရွက်ကြီးသောက်သုံးခြင်းမှ ဓာတ်ရောင်ခြည်သင့်မှုသည် အခြားအရာများမှသက်ရောက်မှုထက် များစွာပိုမိုကြောင်း အနာရောဂါထိန်းချုပ်မှုဗဟို ဌာန မှကြေငြာခဲ့သည်။ စာရင်းဇယားများအရ ကင်ဆာ ကြောင့်သေဆုံးသူများ၏ ၃၀%နှုန်းသည် ဆေးလိပ်သောက်ခြင်းကြောင့်ဖြစ်သည်။ အမျိုးသားကင်ဆာ ရောဂါဆိုင်ရာ လူမှုရေးအသင်းအဖွဲ့များမှ နှစ်စဉ်ငွေကြေးပမာဏ ၅၀၀ မီလီယမ်ဒေါ်လာခန့် အသုံးပြုကြသော်လည်း အဆုပ်ကင်ဆာရောဂါကို အဓိကဖြစ်စေသော သာမာန် ရေဒွန်ဒြပ်စင် (သို့မဟုတ်) ဆေးလိပ်သောက်ခြင်းမှထွက်ပေါ်လာသော ရေဒီယိုသတ္တိကြွဓာတ်ရောင်ခြည်များကို သုသေသနများ ပြုလုပ်ရန် နှင့် လူသားတို့၏ ရေဒီယိုသတ္တိကြွဓာတ်ရောင်သင့်ခြင်း အန္တရာယ်ကို ကာကွယ်ရန် လုပ်ငန်းများ အတွက်ထိရောက်သောထောက်ပံ့မူမရှိခဲ့ပေ။
ပတ်ဝန်းကျင်သို့ သက်ရောက်မှုများ
ရှင်သန်နေသောဆဲလ်များအတွင်း အဆိပ်ဖြစ်စေသောအရာများ ဝင်ရောက်စုပုံနေခြင်းကို ကောင်းစွာ သိရှိနိုင်ရန် ခက်ခဲသောကြောင့် ပိုလိုနီယမ်(Polonium)သည် ဇီဝဓာတုဗေဒနယ်ပယ် နှင့် သဘာဝပတ်ဝန်ကျင် အပေါ် များစွာ လွှမ်းမိုးလျှက်ရှိသည်။ ပိုလိုနီယမ်(Polonium)သည် သဘာဝဝန်းကျင်တွင် တွေ့ရှိရသောကြောင့် ၎င်းသည် ရေ၊အစားအစာ၊ရှင်သန်နေသောဆဲလ် များနှင့် တစ်ရှူးများအတွင်းသို့ ပိုမိုလွယ် ကူစွာဝင်ရောက်နိုင်သည်။
ကိုးကား
- "Relativistic Effects and the Chemistry of the Heavier Main Group Elements" (2010): 78. doi:.
- Polonium's Most Stable Isotope Gets Revised Half-Life Measurement။ NIST Tech Beat။ 9 September 2014 တွင် ပြန်စစ်ပြီး။